OVERZICHT EN IMPACT OP WERFEN
Verordening in-vitrodiagnostiek (IVDR)
What is IVDR?
IVDR is een nieuwe Europese verordening (EU 2017/746), van toepassing op alle huidige en nieuwe medische hulpmiddelen voor in-vitrodiagnostiek (IVD). Deze verordening vervangt de huidige Europese richtlijn IVDD (Richtlijn 98/79/EG) voor IVD-apparaten.
Gebieden
Als Europese verordening zal IVDR van kracht zijn in alle lidstaten van de Europese Unie (EU) en de landen van de Europese Vrijhandelsovereenkomst (EVA).
EU-lidstaten:
Oostenrijk, België, Bulgarije, Kroatië, Cyprus, Tsjechië, Denemarken, Estland, Finland, Frankrijk, Duitsland, Griekenland, Hongarije, Ierland, Italië, Letland, Litouwen, Luxemburg, Malta, Nederland, Polen, Portugal, Roemenië, Slowakije, Slovenië, Spanje en Zweden.
EVA-staten:
IJsland, Liechtenstein, Noorwegen en Zwitserland.
Tijdlijn voor IVDR-implementatie
26 mei 2017: IVDR voor het eerst gepubliceerd, 5-jarige overgangsperiode begint
26 mei 2022: IVDR volledig van kracht
- IVD-apparaten die al in voorraad zijn in EU/EVA-gebieden, kunnen in een uitverkoopperiode worden verkocht of gedistribueerd
- Analyzers die niet IVDR-compatibel zijn, maar vóór 26 mei 2022 zijn verkocht, kunnen tot het einde van de levensduur op de markt blijven
26 mei 2025: Verkoopperiode eindigt voor alle IVD-apparaten; vanaf deze datum kunnen alleen IVDR-compatibele apparaten worden verkocht of gedistribueerd.
IVDR-classificatie
IVDR herclassificeert IVD medische hulpmiddelen, op basis van nieuwe criteria voor klinisch risico geassocieerd met gebruik.
| Klasse | Inhoud |
|---|---|
| Klasse A (laagste risico) | Analysers, reactiecuvetten, schoonmaakoplossingen of andere toebehoren |
| Klasse B (medium risico) | Reagentia, controles of kalibratoren (bijv. gebruikt in de klinische chemie, auto-immuniteit, stolling) |
| Klasse C (hoog risico) | Tests die worden gebruikt in noodomgevingen voor de bewaking van kritieke parameters (bijv. D-dimeer, antistollingstherapiemonitoringtests, prenatale screening, cardiale markers, tumormarkers, zelftesten voor bloedglucose, serologische tests om specifieke virussen te detecteren, zoals HPV, CMV, Rubella) |
| Klasse D (hoogste risico) | Tests die worden gebruikt voor de bepaling van bloedgroepen of infectieziekten (bijv. HIV en hepatitis B/C/D, SARS-CoV-2) |
| Near-patient tests (een nieuwe aanduiding) | Apparaten die in een omgeving in de buurt van de patiënt kunnen worden gebruikt, alleen door een beroepsbeoefenaar in de gezondheidszorg, niet door een patiënt. Near-patient tests worden uitgevoerd door beroepsbeoefenaren in de gezondheidszorg en zelftests worden uitgevoerd door leken. |
*Aanvullende informatie over classificaties: https://ec.europa.eu/health/sites/health/files/md_sector/docs/md_mdcg_2020_guidance_classification_ivd-md_en.pdf
IVDR CE-markeringsvereisten
IVDR Conformitè Europëenne (CE) markering compliance is het keurmerk voor IVD-producten, zo effectief en veilig voor gebruik. Alvorens een hulpmiddel in de Europese handel te brengen, moet een fabrikant de CE-markering verkrijgen door de conformiteitsbeoordeling van het hulpmiddel bij een aangemelde instantie in te vullen. Deze procedure verschilt per apparaat classificatie:
- Klasse A-eisen: Conformiteit en zelfcertificering voor CE-markering, uitgevoerd door de fabrikant.
- Eisen klasse B, C, D: Conformiteit en certificering voor CE-markering, uitgevoerd door een onafhankelijke aangemelde instantie, met goedkeuring vereist voorafgaand aan implementatie en distributie.
Het proces om IVDR-naleving te verkrijgen omvat:
- Het bijwerken van technische documenten, waaronder analytische, klinische prestaties, klinisch bewijs, stabiliteit, risico, productieprocedures en andere relevante bedrijfsprocessen.
- Verificatie van de door de aangemelde instantie vereiste technische en wetenschappelijke competenties.
- Beoordeling van technische documenten om ervoor te zorgen dat aan de IVDR-vereisten wordt voldaan. Apparaten met een hoger risico hebben strengere conformiteitsbeoordelingen.
- Vrijgeven en ondertekenen van de CE-conformiteitsverklaring, na het voldoen aan alle IVDR-vereisten, en vrijgave van het CE-markeringscertificaat door de aangemelde instantie
- Bijwerking van de verpakking, etikettering en gebruiksaanwijzing (in de klassen B, C of D) om de conformiteit weer te geven, met inbegrip van een nieuwe identificatie nummer (xxxx) van de aangemelde instantie, geplaatst in de nabijheid van het CE-markeringssymbool (rechts weergegeven).
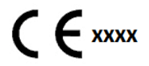
- Geen wijzigingen in ontwerp- of productieprocessen.
Raadpleeg de website van de Europese Commissie voor meer informatie: https://ec.europa.eu/growth/tools-databases/nando/index.cfm?fuseaction=directive.notifiedbody&dir_id=35
Impact op klanten
Zodra de IVDR actief is, zal een centrale Europese database, Eudamed, worden geïmplementeerd. Eudamed zal toegankelijk zijn en specifieke, gerelateerde documenten en informatie bevatten.
Voorbeeld: Certificaten en voorvallen van corrigerende acties in het veld en ernstige ongewenste voorvallen worden gepubliceerd in Eudamed.
IVDR heeft als doel de kwaliteit, veiligheid en betrouwbaarheid van IVD medische hulpmiddelen op de Europese markt te waarborgen. IVDR zal de transparantie van de openbaar beschikbare informatie vergroten.
Gem Premier- en ROTEM-systemen alleen: gedrukte gebruiksaanwijzingen maken nu deel uit van ivdr-etiketteringsvereisten voor near-patient tests. Gedrukte exemplaren van de gebruikershandleidingen voor GEM Premier- en ROTEM-systemen worden aan gebruikers verstrekt voordat ivdr wordt geïmplementeerd.